THỰC HÀNH LÂM SÀNG TRONG ĐIỀU TRỊ TỔN THƯƠNG THẬN CẤP NẶNG
THỰC
HÀNH LÂM SÀNG
TRONG
ĐIỀU TRỊ TỔN THƯƠNG THẬN CẤP NẶNG
I.
Ca lâm sàng:
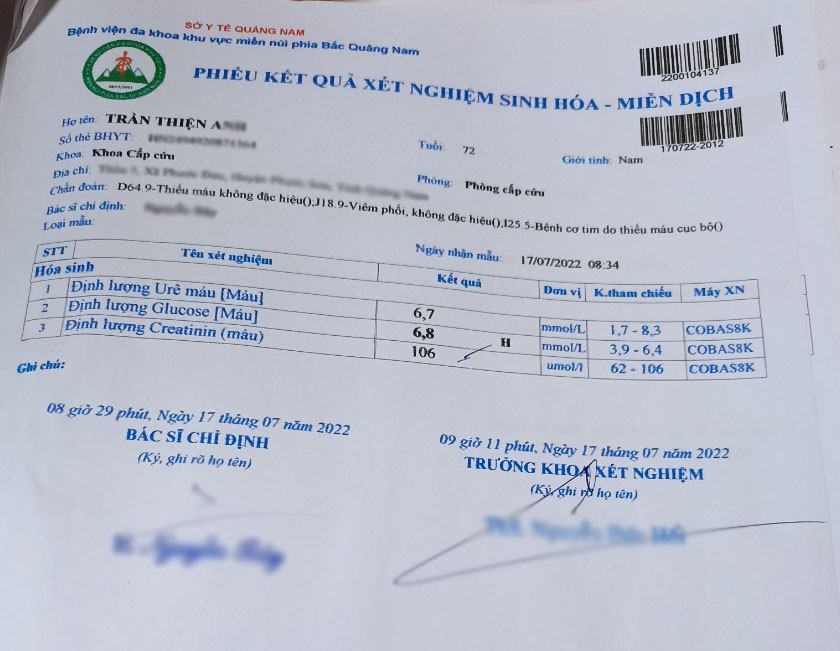
Bệnh nhân Trần Thiện A, 72 tuổi, địa chỉ Phước Đức,
Phước Sơn, Quảng Nam.
Tiền sử: Bệnh cơ tim thiếu máu cục bộ, suy tim EF giảm,
không có tiền sử suy thận trước đây.
Vào viện ngày 17/7/2022 với đau đầu, khó thở, tần số
thở 25 lần/phút, SpO2 81%, rale ẩm rải rác hai phế trường, sốt 39 độ C, HA:
150/100mmHg, Creatinin (17/7): 106 umol/l, ure: 6,7mmol/l. Bệnh được chẩn đoán
viêm phổi cộng đồng và được điều trị với thở oxy 2 lít/phút Cefoxitine 2g x 01
lọ TMC. 15h30, cùng ngày, người bệnh lơ mơ, HA 100/60 mmHg SpO2 50%, phổi rale ẩm
nổ 2 bên, PH: 7,177, siêu âm tim: giảm động chung tất cả các thành thất trí, chức
năng tâm thu thấp trái giảm nặng EF 30%. Xử trí đặt nội khí quản, thở máy mode
A/VC, Amikacin 500mg TTM, Furosemid 20mg x 04 ống TMC, đông miên, vận mạch
Noradrenalin, dobutamin. Ngày 19/7 bệnh nhân có nhịp tự thở, rút nội khí quản,
thở oxy qua mask 3 l/p, đặt sonde tiểu lưu theo dõi nước tiểu. 16h30 ngày 20/7
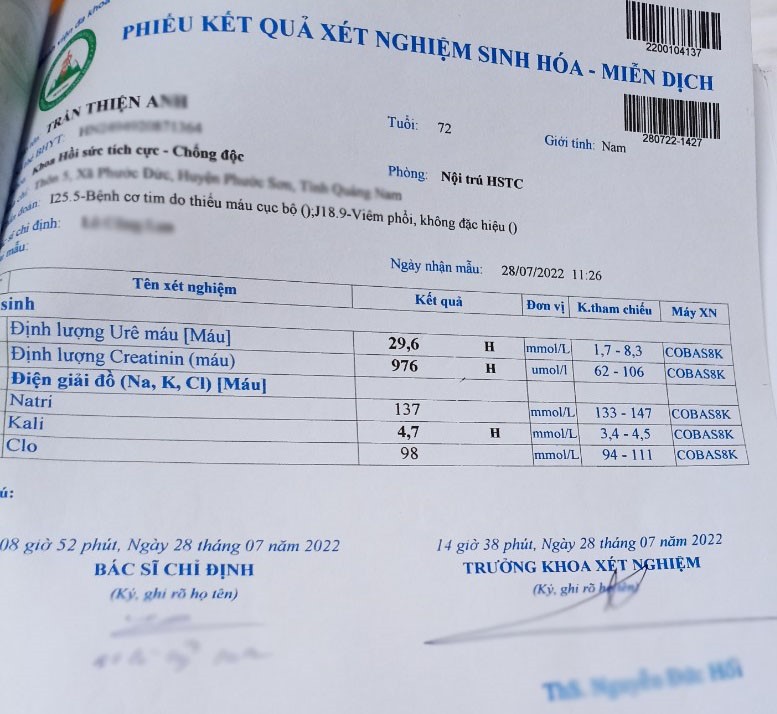
xét nghiệm ure 20 mmol/L, creatinine 650 umol/l, nước tiểu 1l/24h, chẩn đoán
suy thận cấp, ngưng Amikacin. Ngày 25/7 bệnh nhân xét nghiệm ure 29.8 mmol/l,
creatinine 977 umol/l, bệnh được hội chẩn với khoa thận nhân tạo, được chẩn
đoán tổn thương thận cấp độ III theo AKI có chỉ định chạy thận cấp cứu, sau đó
chạy thận chu kỳ 2 lần/tuần.
Ngày 31/7, Bệnh ổn định về mặt tri giác, huyết động,
hô hấp, không còn phụ thuộc vào máy thở và vận mạch nên được chuyển đến khoa Nội
Thận điều trị vào ngày 31/07/2022. Bệnh nhân tỉnh, tiếp xúc tốt, da nhợt nhạt,
không phù nhiệt độ 37 độ C, huyết áp 100/60 mmHg, tim đều, không đau ngực, phổi
thông khí rõ, tiểu ít # 300ml/24h, cầu bàng quang (-), tiểu khó, tiểu đêm, tiền
sử tăng sinh lành tính tuyến tiền liệt, sốt cao rét run lúc chạy thận, nhiệt độ
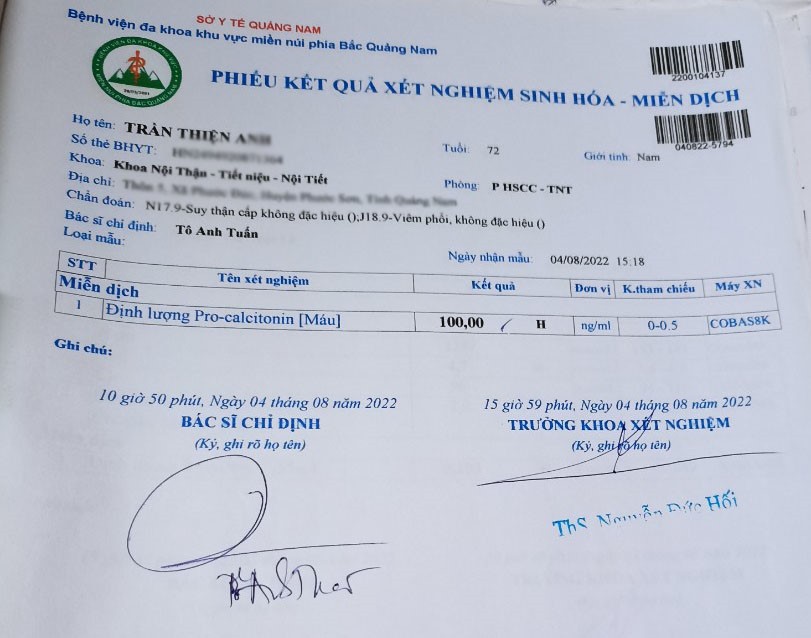
39 độ C. Cận lâm sàng: Creatinin: 899 umol/l, ure: 30,9 mmol/l, Pro-calcitonin
100 ng/ml, siêu âm bụng: bệnh lý chủ mô thận mạn hai bên. Xét nghiệm ure trước
và sau chạy thận cho thấy Kt/V = 0,96.
Nhận định
các vấn đề trên bệnh nhân:
-
Tiểu ít # 300ml/24h, creatinin tăng cao từ
106 umol/l (17/7) đến 899 umol/l dù đang chạy thận nhân tạo 2 lần/tuần. Chẩn
đoán tổn thương thận cấp độ III theo AKI/ sock tim/suy hô hấp nặng, tiên lượng tử vong cao (40-50%).
-
Chạy
thận với Kt/V/ = 0,9, do đó bệnh nhân cần được tăng thời gian và số lần chạy thận
nhân tạo nhằm đạt mục tiêu Kt/V/lần = 1,2 với 3 lần/tuần.
-
Bệnh
nhân có sốt cao mỗi lẫn chạy thận nhân tạo, pro-calcitonin máu 100 ng/ml, chẩn
đoán: Nhiễm trùng huyết tiêu điểm tại catheter chạy thận. Bệnh được hội chẩn dược
lâm sàng thống nhất dùng Doripenem 250mg/24h + Vancomycin liều tải 20mg/kg và
liều duy trì 7.5mg/kg/48h thay catheter chạy thận, cấy máu và cấy bệnh phẩm tại
catheter.
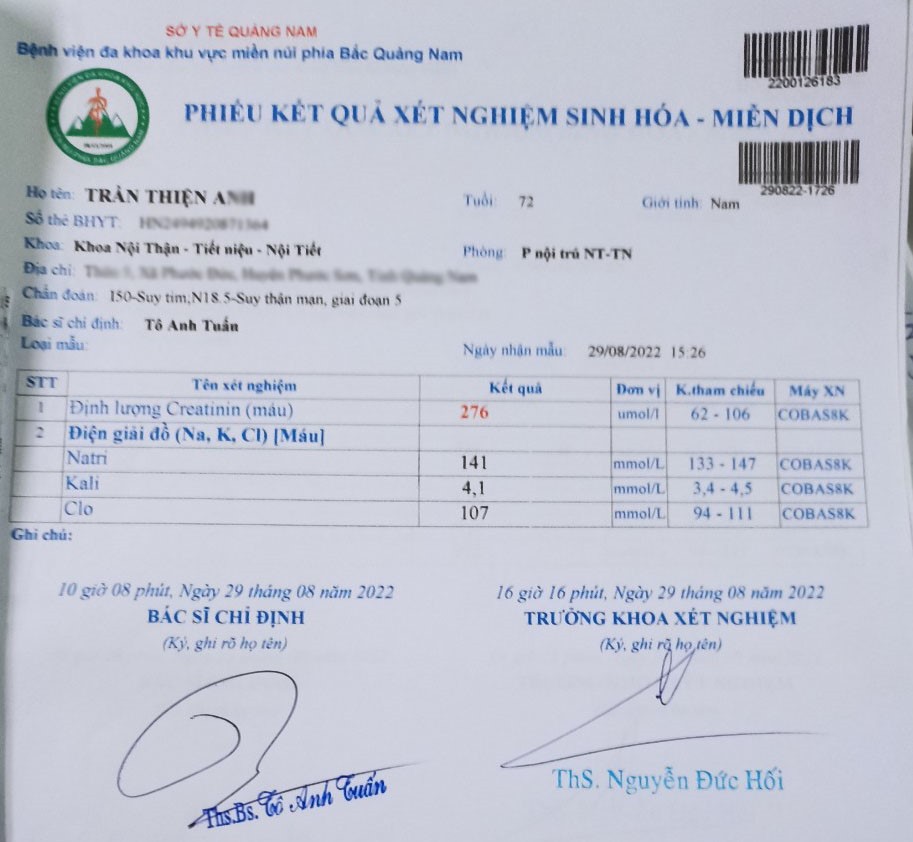
Ngày 10/8/2022, Bệnh nhân cảm thấy khoẻ hơn, HA:
120/60 mmHg, lượng nước tiểu khoảng 2l/ngày, creatinine (8/8): 429 umol/l,
ngưng chạy thận nhân tạo trên bệnh nhân. Ngày 29/8: creatinin: 276 umol/l, lượng
nước tiểu 2l/ngày, bệnh được cho ra viện, tư vấn cách theo dõi bệnh, tránh các thuốc
độc cho thận, tái khám.
Các kinh
nghiệm rút ra trênh bệnh nhân này:
- Bệnh nhân được chỉ định chạy thận nhân tạo trên bệnh
nhân tổn thương thận cấp mức độ AKI 3, toan máu PH = 7,17 và rối loạn tri giác,
thiểu niệu. Ngoài các điều trị AKI như ngưng các tác nhân gây tổn thương thận cấp
(như thuốc
kháng viêm không steroid (NSAID), thuốc ức chế men chuyển (ACE), thuốc chẹn thụ
thể angiotensin (ARB),…), cân bằng thể dịch,
điều trị các rối loạn điện giải, nhiễm toan chuyển hóa, theo dõi huyết động,
nước tiểu, creatinin máu, tránh tăng đường huyết… việc chỉ định thay thế thận phù
hợp cũng rất quan trọng trong điều trị tổn thương thận cấp nặng.
- Tăng liều chạy thận nhân tạo nhằm đạt mục tiêu
Kt/V/lần = 1,2 và 3 lần/tuần hoặc
tăng tần suất chạy thận giúp cải thiện tốt hơn chức năng thận trên bệnh
nhân tổn thương thận cấp nặng.
- Tìm các nguyên nhân làm nặng, như nhiễm trùng huyết và điều trị giúp giảm nguy cơ tử vong và cải thiện chất lượng điều trị.
II. Liệu pháp thay thế thận trong tổn thương thận cấp
ở người lớn: Chỉ định, thời gian và liều lọc máu
(Kidney replacement therapy (dialysis) in acute kidney injury in adults:
Indications, timing, and dialysis dose)
2.1. Giới thiệu:
Xử
trí bệnh nhân tổn thương thận cấp (AKI) là hỗ trợ, với liệu pháp thay thế thận
(KRT) được chỉ định ở bệnh nhân tổn thương thận cấp nặng. Nhiều phương thức KRT
có sẵn. Chúng bao gồm chạy thận nhân tạo ngắt quãng (IHD); các liệu pháp thay
thế thận liên tục (CKRTs); và liệu pháp kết hợp, còn được gọi là liệu pháp thay
thế thận ngắt quãng kéo dài (PIKRT). Bất chấp những kỹ thuật đa dạng này, tỷ lệ tử vong ở bệnh nhân AKI vẫn cao, vượt quá 40 đến 50% ở những bệnh nhân AKI
nặng.
Bắt
đầu KRT ở bệnh nhân AKI ngăn ngừa tăng ure máu và tử vong ngay lập tức do các
biến chứng bất lợi của suy thận. Có thể những thay đổi về thời gian bắt đầu,
cách thức và / hoặc liều dùng có thể ảnh hưởng đến kết quả lâm sàng, đặc biệt
là tỷ lệ sống sót, mặc dù có rất ít nghiên cứu trực tiếp xem xét những vấn đề
này.
2.2. Chỉ định thay thế thận khẩn cấp
Các
chỉ định thay thế thận khẩn cấp được đồng thuận ở bệnh nhân AKI thường bao gồm:
● Quá tải chất
lỏng dai dẳng
● Tăng kali máu nghiêm trọng (nồng độ kali
huyết tương> 6,5 mEq / L) hoặc nồng độ kali tăng nhanh
● Các dấu hiệu của tăng ure máu, chẳng hạn như
viêm màng ngoài tim, bệnh não hoặc suy giảm tri giác không giải thích được
● Nhiễm toan chuyển hóa nặng (pH <7,1)
● Một số trường hợp ngộ độc rượu và thuốc.
Khả
năng cần KRT tăng lên ở những bệnh nhân mắc suy thận mạn (CKD) tiềm ẩn tương
ứng với mức độ giảm mức lọc cầu thận (GFR) lúc ban đầu. Điều này đã được minh
họa trong một nghiên cứu so sánh GFR ước tính trước khi nhập viện (eGFR; từ
creatinine huyết thanh gần đây nhất) ở 1746 bệnh nhân nhập viện phát triển AKI
cần lọc máu với 600.820 bệnh nhân nhập viện không điều trị [8]. So với những
bệnh nhân có GFR ban đầu ước tính> 60 ml/phút / 1,73 m2, nguy cơ phát triển
AKI cần lọc máu tăng dần và tăng đáng kể với mức độ nghiêm trọng của bệnh thận
mạn. Các tỷ số chênh lệch (OR) được điều chỉnh là 1,7; 4,6 và 20,4 đối với bệnh
nhân CKD giai đoạn 3 (eGFR từ 30 đến 59 ml/phút / 1,73 m2), 4 (eGFR từ 15 đến
29 ml/phút / 1,73 m2) và 5 (eGFR <15 ml/phút / 1,73 m2), tương ứng.
2.3. Chỉ định thay thế thận chọn lọc
Ngay
cả khi một trong các chỉ định khẩn cấp không được đáp ứng, chúng tôi bắt đầu
chủ động KRT ở những bệnh nhân bị AKI không có khả năng cải thiện nhanh chóng
và những bệnh nhân có một hoặc nhiều điều sau đây [20]:
· Kali
huyết thanh> 6,0 mEq/L, hoặc> 5,5 mEq/L nếu có sự phân hủy mô
đang diễn ra (ví dụ, tiêu cơ vân, tổn thương dập nát, hội chứng ly giải
khối u), hoặc hấp thu kali đang diễn ra
(ví dụ, do xuất huyết tiêu hóa nặng). Lựa chọn bắt đầu KRT ở bệnh nhân trước
khi kali đạt 6,5 mEq/L có thể giúp tránh việc chỉ định cấp cứu và loạn nhịp tim
có thể đe dọa tính mạng.
· Nhiễm
toan chuyển hóa nặng (pH <7,2) mặc dù đã được quản lý y
tế tối ưu (ví dụ, với liệu pháp bicarbonat tĩnh mạch) hoặc nếu không thể truyền natri bicarbonat tĩnh mạch một cách an toàn do
quá tải thể tích. Tuy nhiên, ở những bệnh nhân sản xuất nhiều axit lactic (ví
dụ, ở bệnh nhân thiếu máu cục bộ ruột), chỉ riêng KRT thường không đủ để loại
bỏ lactate và điều chỉnh tình trạng nhiễm toan chuyển hóa khoảng trống anion.
Trong những tình huống như vậy, KRT thường được sử dụng như một liệu pháp hỗ
trợ, việc xử trí dứt điểm nguyên nhân chính của nhiễm toan lactic là quan trọng
(ví dụ: cắt bỏ đoạn ruột bị thiếu máu cục bộ).
· Bệnh
nhân tăng thể tích tuần hoàn bị thiểu niệu (Thiểu niệu được định nghĩa là lượng nước tiểu ít hơn 400 ml
mỗi ngày hoặc ít hơn 20 ml mỗi giờ) hoặc người vẫn trong tình trạng quá tải dịch dai dẳng mặc dù dùng liều
cao lợi tiểu quai (thường được sử dụng kết hợp với thiazide hoặc thuốc lợi tiểu
giống thiazide), đặc biệt nếu nhu cầu
oxy ngày càng tăng. Chọn khởi đầu lọc máu ở những bệnh nhân này có thể giúp
tránh phải đặt nội khí quản và thở máy.
Chúng
tôi không sử dụng giá trị nitơ urê máu (BUN) để đưa ra quyết định về thời điểm
bắt đầu KRT. Điều này là do BUN thường bị ảnh hưởng bởi một số yếu tố không
liên quan đến chức năng thận (ví dụ, xuất huyết tiêu hóa, sử dụng glucocorticoid
liều cao). Chúng tôi cũng không sử dụng bất kỳ ngưỡng thời gian cụ thể nào (ví
dụ, 72 giờ của AKI nặng) để bắt đầu KRT trong trường hợp không có các chỉ định
được trình bày ở trên [20].
Nhiều thử nghiệm đã so sánh các chiến lược
bắt đầu KRT sớm (trong trường hợp không có bất kỳ chỉ định nào được đề cập ở
trên) với khởi đầu KRT chậm (khi đã có chỉ định). Trong một phân tích tổng hợp
của chín nghiên cứu và 1879 bệnh nhân, bắt đầu KRT sớm không làm giảm tỷ lệ tử
vong ở 28 (43 so với 44 phần trăm), 60 (51 phần trăm ở cả hai nhóm), hoặc 90
ngày (56 so với 55 phần trăm) [7]. Tất cả bệnh nhân trong nhóm bắt đầu sớm
đều được KRT, so với 58% ở nhóm bắt đầu muộn. Không có sự khác biệt về nguy cơ
tăng kali máu, rối loạn nhịp tim nặng hoặc các biến cố chảy máu nghiêm trọng.
Khi ra viện, không có sự khác biệt giữa các nhóm về tỷ lệ bệnh nhân phụ thuộc
KRT, về creatinin huyết thanh ở những người không phụ thuộc KRT, hoặc sử dụng
máy thở hoặc thuốc vận mạch.
2.4.
Phương pháp thay thế thận tối ưu
Một số lượng lớn các phương thức có sẵn
cho KRT. Chúng bao gồm chạy thận nhân tạo ngắt quãng (chu lỳ) (IHD), thẩm phân
phúc mạc, liệu pháp thay thế thận liên tục (CKRT).
Dữ liệu không hỗ trợ tính ưu việt của bất
kỳ chế độ KRT cụ thể nào ở bệnh nhân AKI. Do đó, ở phần lớn bệnh nhân, việc lựa
chọn phương thức điều trị nên dựa trên chuyên môn của địa phương và sự sẵn có của
nhân viên và thiết bị. Tuy nhiên, ở những bệnh nhân cụ thể, các yếu tố bệnh kèm
có thể chiếm ưu thế trong chỉ định phương pháp KRT phù hợp. Ví dụ, ở những bệnh
nhân bị tổn thương não cấp tính hoặc suy gan tối cấp, điều trị lọc máu liên tục
có thể giúp bảo tồn tưới máu não tốt hơn. Tuy nhiên, chi phí liên quan đến CKRT
có thể lớn hơn so với các phương thức KRT khác.
Các phân tích tổng hợp so sánh kết quả với
CKRT và IHD cũng đã được thực hiện. Nhìn chung, không có lợi ích sống còn nào
có thể được quy cho cả hai phương thức.
Trong
nghiên cứu HemoDiafe (một nghiên cứu tiền cứu, đa trung tâm, Pháp), 360 bệnh
nhân bị AKI và hội chứng rối loạn chức năng đa cơ quan được phân ngẫu nhiên vào
IHD hoặc lọc máu tĩnh mạch liên tục (CVVHDF) [28]. Tiêu chí chính là sống sót sau 60
ngày. Mức độ nghiêm trọng của bệnh là như nhau ở cả hai nhóm ngẫu nhiên, tuân
thủ quy trình tốt, cả hai nhóm đều sử dụng cùng một màng lọc máu và có tỷ lệ
chuyển đổi chéo từ các liệu pháp ngắt quãng sang liên tục thấp (3,3%). Ở 60
ngày, tỷ lệ sống sót là như nhau ở cả hai nhóm (lần lượt là 32 và 33% ở nhóm ngắt
quãng và liên tục). Ngoài ra, cả hai liệu pháp đều có tỷ lệ hạ huyết áp tương tự
nhau, bao gồm cả nhóm bệnh nhân huyết động không ổn định.
Phục
hồi chức năng thận - Phục hồi chức năng thận dường như giống nhau với CKRT và
IHD. Mặc dù một số nghiên cứu báo cáo khả năng hồi phục tốt hơn với CKRT [24] [13] [9] [2], những báo cáo này chỉ đánh giá sự phục
hồi chức năng thận ở những bệnh nhân sống sót, do đó không tính đến sự khác biệt
về tỷ lệ tử vong giữa các nhóm. Khi phân tích kết hợp tỷ lệ tử vong và không phục
hồi chức năng thận, cả hai nhóm đều cho thấy chức năng hồi phục tương tự nhau [19] [17]. Các nghiên cứu ngẫu nhiên cũng không
tìm thấy lợi ích như vậy với CKRT [28] [1] [28] [1] [26]. Những quan sát này đã được xác nhận
trong một phân tích tổng hợp bao gồm 3971 người sống sót sau AKI cần KRT. Một
phân tích tổng hợp của 16 nghiên cứu quan sát (n = 3499) cho thấy tỷ lệ phụ thuộc
vào lọc máu liên quan đến IHD cao hơn, nhưng phân tích bảy thử nghiệm ngẫu
nhiên (n = 472) cho thấy không có sự khác biệt về phục hồi chức năng thận giữa
các nhóm [25]. Các phát hiện tương tự đã được báo cáo
trong một phân tích tổng hợp thứ hai [14].
Những
điểm khác biệt khác - CKRT cho thấy có những ưu điểm sau so với IHD:
Tăng
cường ổn định huyết động, có thể đặc biệt có lợi ở những bệnh nhân không ổn
định về huyết động [1]. Sự ổn định huyết động được cho là có
liên quan đến việc loại bỏ chất tan, thể tích chậm hơn và nguy cơ hạ thân nhiệt
ít hơn với CKRT.
Loại
bỏ muối và nước ổn định hơn, đặc biệt ở những bệnh nhân không ổn định về
huyết động, do đó cho phép điều chỉnh dần dần tình trạng quá tải thể tích và
nhu cầu dinh dưỡng [1] [3].
Tăng cường thanh thải các chất trung
gian gây viêm, có thể
mang lại lợi ích ở những bệnh nhân nhiễm trùng huyết, đặc biệt là sử dụng
các chế độ đối lưu (convective modes) của điều trị liên tục [21] [12, 23]. Tuy nhiên, một phân tích tổng hợp
về sự đối lưu và sự khuếch tán cho thấy không có lợi cho sự đối lưu [1]. Các thử nghiệm ngẫu nhiên, có đối chứng
cũng không cho thấy lợi ích của lọc máu khối lượng lớn trong nhiễm trùng huyết [10] hoặc sốc tim sau phẫu thuật tim [4]. Một số yếu tố có thể góp phần vào việc
thiếu lợi ích này. Mặc dù liệu pháp đối lưu có thể giúp tăng cường thanh thải
các chất trung gian tiền viêm, nhưng nó cũng có thể dẫn đến việc loại bỏ các chất
trung gian kháng viêm có lợi. Ngoài ra, độ thanh thải ngoài cơ thể tối đa đạt
được của các chất trung gian này thấp so với tốc độ sinh ra và thanh thải nội
sinh.
Trong số những bệnh nhân bị phù
não, tổn thương não cấp tính, hoặc suy gan tối cấp, lọc máu liên tục có thể
giúp bảo tồn tưới máu não tốt hơn [5].
Thẩm phân phúc mạc - Thẩm phân phúc mạc (PD) có một lịch sử
lâu đời được sử dụng trong điều trị AKI, nhưng hiện nay ít được sử dụng ở Hoa Kỳ
và nhiều quốc gia khác.
PD cấp, nếu có, là một giải pháp thay thế
hợp lý cho các phương thức hỗ trợ thận ngoài cơ thể (tức là IHD, PIKRT và
CKRT). Mặc dù PD có thể được sử dụng để quản lý AKI ở hầu hết các cài đặt,
nhưng nó có thể có lợi cụ thể trong các trường hợp sau [15]:
Bệnh
nhân mắc AKI ở những nơi không có thiết bị để thực hiện chạy thận nhân tạo,
PIKRT hoặc CKRT
Bệnh nhân có nguy cơ chảy máu cao khi
dùng thuốc kháng đông
Bệnh nhân suy tim không kiểm soát được
và những người cần lọc máu để điều trị AKI
Bệnh nhân xơ gan và cổ trướng
Tuy nhiên, PD cấp tính thường nên
tránh ở các nhóm bệnh nhân sau [15]:
Bệnh nhân đã trải qua phẫu thuật bụng trong
vòng vài tuần trước khi mắc AKI cần lọc máu. Ngay cả trong số những bệnh
nhân có sự hiện diện của thoát vị ổ bụng hoặc dính trong ổ bụng có thể ảnh hưởng
đến hiệu quả của PD cấp cứu.
Bệnh
nhân có thông màng phổi cơ hoành (diaphragmatic
pleuroperitoneal connections)
Suy
hô hấp nặng hoặc đe doạ tính mạn
Kali
máu tăng cao hoặc nhanh
Nhiễm
trùng ổ bụng hoặc viêm mô tế bào thành bụng
Bệnh
nhân có các tình trạng khác như bệnh trào ngược dạ dày thực quản nặng, mang
thai, hoặc ĐTĐ không kiểm soát được nên được đánh giá tùy từng trường hợp để
biết mức độ phù hợp của chỉ định PD cấp [22]. Đây không
phải là những chống chỉ định tuyệt đối đối với PD cấp nhưng có thể cần điều
chỉnh liều hoặc các điều chỉnh khác để đảm bảo PD an toàn.
2.5. Liều tối ưu
2.5.1. Thận nhân tạo ngắt quãng (chu kỳ)-
Liều lượng trong chạy thận nhân tạo ngắt quãng (IHD) được dựa trên liều lượng
phân phối mỗi phiên, cũng như tần suất của phiên.
Không
có nghiên cứu nào đánh giá tiền cứu tác động của sự khác biệt về liều lượng mỗi
phiên ở những bệnh nhân trải qua IHD theo một lịch trình cố định, chẳng hạn như
ba lần mỗi tuần.
Trong
một nghiên cứu đánh giá tác động của tần suất IHD đối với kết quả, 160 bệnh
nhân bị AKI được chỉ định chạy thận nhân tạo hàng ngày hoặc cách ngày [24]. Những bệnh
nhân được ghi danh có thể có mức độ nghiêm trọng của bệnh tật ở mức trung bình,
được hỗ trợ bởi cả điểm đánh giá sức khỏe sinh lý cấp tính và mãn tính (APACHE)
và cung cấp đồng thời liệu pháp thay thế thận liên tục (CKRT) tại trung tâm
nghiên cứu. So với lọc máu cách ngày, liệu pháp hàng ngày có liên quan đến việc
giảm đáng kể tỷ lệ tử vong (28 so với 46%), ít đợt hạ huyết áp hơn khi chạy
thận nhân tạo và AKI giải quyết nhanh hơn (trung bình 9 so với 16 ngày). Liều
lọc máu được phân phối ở nhóm cách ngày, được đánh giá bằng Kt/V một nhóm, là
thấp (0,94 mỗi lần lọc máu). Để so sánh, nhóm lọc máu hàng ngày nhận được cùng
một liều điều trị được phân phối, nhưng nó được phân phối thường xuyên hơn gấp
đôi. Do đó, nghiên cứu này có thể đưa ra kết luận rằng liệu pháp điều trị không
đầy đủ có liên quan đến việc tăng tỷ lệ tử vong.
Các
hướng dẫn về Bệnh thận 2012: Cải thiện Kết quả Toàn cầu (KDIGO) cho AKI khuyến
nghị cung cấp Kt/V là 3,9 mỗi tuần cho bệnh nhân đang điều trị thận nhân tạo
ngắt quãng [11]. Mặc dù những
kết quả này dựa trên kết quả của nghiên cứu ATN, nhưng một số lưu ý cần được
xem xét. Trong nghiên cứu ATN, liều mục tiêu của IHD ở cả hai nhóm điều trị là
Kt/V từ 1,2 đến 1,4 mỗi lần chạy thận, với Kt/V trung bình là 1,3 cho mỗi lần
điều trị [27]. Liều chạy
thận nhân tạo hàng tuần được khuyến nghị trong hướng dẫn KDIGO là tổng số học
của liều trung bình ở mỗi lần chạy thận trong thời gian một tuần. Vì Kt/ V phân
phối trung vị là 1,3 ngụ ý rằng một nửa số lần điều trị có Kt/Vđược phân phối
thấp hơn giá trị này, nên không rõ ràng rằng liều mỗi lần điều trị là 1,3 thể
hiện mục tiêu thích hợp. Ngoài ra, cách tiếp cận lấy tổng số học của liều chạy
thận riêng lẻ để tính liều hàng tuần không phù hợp với mô hình động học urê;
liều hàng tuần được cung cấp bởi sáu lần chạy thận với liều Kt/Vlà 0,65 không
tương đương với ba lần với Kt/Vlà 1,3 [18].
Do đó, chúng tôi khuyến nghị rằng, nếu
IHD được cung cấp ba lần mỗi tuần, thì liều điều trị mục tiêu phải là Kt/V ≥ 1,2 mỗi lần chạy thận. Nếu đạt
được liều tối thiểu này, không có bằng chứng nào cho thấy chạy thận nhân tạo
thường xuyên hơn có liên quan đến cải thiện kết quả, trừ khi cần thiết cho các
chỉ định cấp tính cụ thể (ví dụ, tăng kali máu). Ngược lại, nếu không thể đạt
được Kt/V ≥ 1,2 trên mỗi lần chạy thận thì nên tăng tần suất chạy thận [20].
Nếu cung cấp IHD thường xuyên hơn, liều
mục tiêu cho mỗi lần chạy thận có thể thấp hơn; tuy nhiên, liều tối ưu không được
xác định. Các khảo sát về thực hành ở Hoa Kỳ cho thấy rằng việc theo dõi Kt/V
trong chạy thận nhân tạo chỉ được đánh giá không thường xuyên [16].
Có thể cần phải chạy thận nhân tạo thường
xuyên hơn để quản lý thể tích ở những bệnh nhân mắc một hoặc nhiều bệnh sau:
quá tải thể tích nghiêm trọng; một trạng thái tăng trao đổi chất trong đó chạy
thận nhân tạo ba lần một tuần không đủ để kiểm soát tăng BUN, creatinin máu,
nhiễm toan hoặc tăng kali máu; và khi không thể đạt được liều điều trị mục
tiêu.
Nghiên cứu kết quả lọc máu tại Hanover
(HAND-OUT) so sánh lọc máu kéo dài thời gian (EDD), được cung cấp khoảng tám giờ
mỗi ngày, với một chế độ chuyên sâu hơn trong đó các phiên điều trị bổ sung kéo
dài tám giờ để duy trì nitơ urê trong máu (BUN) <42 mg/dl [6]. Không có sự khác biệt về khả năng sống
sót hoặc phục hồi chức năng thận khi điều trị chuyên sâu hơn.
Liều tối ưu của phương pháp thay thế thận
liên tục không được nói trong bài này do tại cơ sở thực hành của chúng tôi chưa
triển khai phương pháp này.
2.6.
Thời điểm ngừng thay thế thận:
KRT thường được tiếp tục cho đến khi bệnh
nhân có bằng chứng về sự phục hồi chức năng thận. Ở những bệnh nhân thiểu
niệu, biểu hiện chính của sự phục hồi chức năng thận là lượng nước tiểu tăng
lên; tuy nhiên, phát hiện này có thể không rõ ràng ở những bệnh nhân không thiểu
niệu. Sự phục hồi chức năng thận cũng có thể được biểu hiện bằng sự suy giảm dần
nồng độ creatinin huyết thanh sau khi đạt được giá trị ổn định ban đầu (được
đánh giá hàng ngày trong khi điều trị thay thế thận liên tục [CKRT] hoặc trước
lọc máu ở bệnh nhân được điều trị bằng IHD) mặc dù liều lượng không đổi KRT. Có
thể đánh giá khách quan hơn về sự phục hồi chức năng thận bằng cách đo độ thanh
thải creatinin. Ví dụ, trong nghiên cứu của Mạng lưới Thử nghiệm Suy thận Cấp
tính (ATN), độ thanh thải creatinin được đánh giá dựa trên việc thu thập nước
tiểu theo thời gian sáu giờ thu được khi lượng nước tiểu vượt quá 30 mL/giờ [27]. Vì nồng độ creatinin huyết thanh có thể
không ổn định trong suốt quá trình lấy mẫu, nên có thể ước tính nồng độ trung
bình bằng cách đo creatinin huyết thanh vào thời điểm bắt đầu và kết thúc thời
gian thu thập hoặc dựa trên nồng độ creatinin huyết thanh điểm giữa. Mức độ
chính xác của chức năng thận cần thiết để cho phép ngừng KRT chưa được thiết lập;
tuy nhiên, độ thanh thải creatinin <12 ml/phút có lẽ không đủ để cho phép ngừng
điều trị. Trong nghiên cứu ATN, KRT ngừng khi độ thanh thải creatinin vượt quá
20 ml/phút và bác sĩ có thể cân nhắc nhưng khi độ thanh thải
creatinin trong khoảng 12 đến 20 ml/phút [27].
2.7.
Tóm tắt
Các chỉ định khẩn cấp cho liệu
pháp thay thế thận (KRT) ở bệnh nhân tổn thương thận cấp tính (AKI) bao gồm quá
tải thể tích không cải thiện với thuốc lợi tiểu, tăng kali máu nghiêm trọng
(kali huyết thanh> 6,5 mEq / L), nhiễm toan chuyển hóa nặng (và pH <7,1),
hội chứng tăng ure máu, và ngộ độc một số thuốc (có thể lọc được)
Ngay cả khi một trong những chỉ định khẩn
cấp không được đáp ứng, chúng tôi bắt đầu KRT chủ động ở những bệnh nhân bị AKI
không có khả năng giải quyết nhanh chóng và có một hoặc nhiều vấn đề sau đây:
• Kali huyết thanh> 6,0 mEq / L, hoặc>
5,5 mEq / L nếu có sự phân hủy mô đang diễn ra (ví dụ, tiêu cơ vân, tổn thương
dập nát, hội chứng ly giải khối u), hoặc hấp thu kali đang diễn ra (ví dụ, xuất
huyết tiêu hóa nặng).
• Nhiễm toan chuyển hóa nặng (pH
<7,2) mặc dù đã được điều trị tối ưu (ví dụ, với liệu pháp bicarbonat tĩnh mạch)
hoặc nếu không thể truyền natri bicarbonat tĩnh mạch một cách an toàn do quá tải
thể tích.
• Bệnh nhân quá tải thể tích vẫn trong
tình trạng cân bằng dịch dương dai dẳng mặc dù đã cố gắng bài niệu tích cực, đặc
biệt nếu nhu cầu oxy ngày càng tăng.
Chúng tôi khuyến cáo không nên bắt đầu
KRT sớm (tức là bắt đầu trước khi bệnh nhân có chỉ định), vì bắt đầu sớm làm
tăng hiệu quả sử dụng chăm sóc sức khỏe nhưng không cải thiện và có thể xấu đi,
kết quả ở bệnh nhân AKI nặng. Mặt khác, việc bắt đầu KRT chậm trễ quá mức không
mang lại lợi ích và có thể liên quan đến việc tăng nguy cơ dẫn đến các kết cục
bất lợi.
Dữ liệu không ủng hộ tính ưu tiên của liệu
pháp thay thế thận liên tục (CKRT) hoặc chạy thận nhân tạo ngắt quãng (IHD). Do
đó, việc lựa chọn phương thức KRT nên dựa trên chuyên môn và kinh nghiệm của địa
phương kết hợp với nhu cầu của từng bệnh nhân.
Chúng tôi khuyến nghị nên cung cấp IHD
theo lịch trình ba lần mỗi tuần (các ngày xen kẽ), với việc theo dõi liều lọc
máu để đảm bảo cung cấp Kt/V≥ 1,2 cho mỗi lần chạy thận. Có thể cần điều trị
thường xuyên hơn để quản lý thể tích hoặc nếu không thể đạt được liều điều trị
mục tiêu.
Ths.Bs. Tô
Anh Tuấn - Trưởng khoa Nội thận – Tiết niệu – Nội tiết
Từ vựng tiếng anh liên quan:
Azotemia: là một bất thường sinh
hóa, được định nghĩa là tăng hoặc tích tụ các sản phẩm chứa nitơ (BUN-thường
dao động từ 7 đến 21 mg / dL), creatinine trong máu và các chất thải thứ cấp
khác trong cơ thể.
Oliguric: Thiểu niệu được định
nghĩa là lượng nước tiểu dưới 1 mL/kg/h ở trẻ sơ sinh, dưới 0,5 mL/kg/h ở trẻ
em và dưới 400 mL mỗi ngày ở người lớn.
Uremia: thuật ngữ
chỉ lượng urê trong máu cao
Toxic overdose: Đề
cập đến các phản ứng độc hại nghiêm trọng, thường có hại và đôi khi gây tử vong
do quá liều thuốc.
Acute kidney
injury (AKI): Tổn thương thận cấp
Kidney replacement
therapy (KRT): Thay thế thận.
Intermittent
hemodialysis (IHD): Chạy thận nhân tạo ngắt quãng (chu kỳ)
Continuous kidney
replacement therapies (CKRTs): Các liệu pháp thay thế thận liên tục
Prolonged
intermittent kidney replacement therapies (PIKRTs)
Sustained
low-efficiency dialysis (SLED) and extended-duration dialysis (EDD)
Refractory fluid
overload: quá tải dịch kháng trị
Pericarditis: Viêm
màng ngoài tim
Encephalopathy: Có nghĩa là tổn thương hoặc bệnh ảnh
hưởng đến não
life-threatening arrhythmias: Loạn
nhịp tim đe dọa tính mạng
Severe metabolic acidosis (pH
<7.2): Nhiễm toan chuyển hóa nặng.
Tài liệu tham khảo:
1. Augustine JJ, Sandy D,
Seifert TH, Paganini EP. A randomized controlled trial comparing intermittent
with continuous dialysis in patients with ARF. Am J Kidney Dis 2004; 44:1000.
2. Bell M, SWING, Granath F, et
al. Continuous renal replacement therapy is associated with less chronic renal
failure than intermittent haemodialysis after acute renal failure. Intensive
Care Med 2007; 33:773.
3. Bouchard J, Soroko SB,
Chertow GM, et al. Fluid accumulation, survival and recovery of kidney function
in critically ill patients with acute kidney injury. Kidney Int 2009; 76:422.
4. Combes A, Bréchot N, Amour
J, et al. Early High-Volume Hemofiltration versus Standard Care for
Post-Cardiac Surgery Shock. The HEROICS Study. Am J Respir Crit Care Med 2015;
192:1179.
5. Davenport A, Will EJ,
Davison AM. Continuous vs. intermittent forms of haemofiltration and/or
dialysis in the management of acute renal failure in patients with defective
cerebral autoregulation at risk of cerebral oedema. Contrib Nephrol 1991;
93:225.
6. Faulhaber-Walter R, Hafer C,
Jahr N, et al. The Hannover Dialysis Outcome study: comparison of standard
versus intensified extended dialysis for treatment of patients with acute kidney
injury in the intensive care unit. Nephrol Dial Transplant 2009; 24:2179.
7. Gaudry S, Hajage D, Benichou
N, et al. Delayed versus early initiation of renal replacement therapy for
severe acute kidney injury: a systematic review and individual patient data
meta-analysis of randomised clinical trials. Lancet 2020; 395:1506.
8. Hsu CY, Ordoñez JD, Chertow
GM, et al, "The risk of acute renal failure in patients with chronic
kidney disease. Kidney Int 2008; 74:101.".
9. Jacka MJ, Ivancinova X,
Gibney RT. Continuous renal replacement therapy improves renal recovery from
acute renal failure. Can J Anaesth 2005; 52:327.
10. Joannes-Boyau O, Honoré PM,
Perez P, et al. High-volume versus standard-volume haemofiltration for septic
shock patients with acute kidney injury (IVOIRE study): a multicentre
randomized controlled trial. Intensive Care Med 2013; 39:1535.
11. KDIGO clinical practice
guidelines for acute kidney injury. Kidney Int Suppl 2012, 2.
12. Kellum JA, Johnson JP,
Kramer D, et al. Diffusive vs. convective therapy: effects on mediators of
inflammation in patient with severe systemic inflammatory response syndrome.
Crit Care Med 1998; 26:1995.
13. Manns B, Doig CJ, Lee H, et
al. Cost of acute renal failure requiring dialysis in the intensive care unit:
clinical and resource implications of renal recovery. Crit Care Med 2003;
31:449.
14. Nash DM, Przech S, Wald R,
O'Reilly D. Systematic review and meta-analysis of renal replacement therapy
modalities for acute kidney injury in the intensive care unit. J Crit Care
2017; 41:138.
15. Nolph KD. Peritoneal
dialysis for acute renal failure. ASAIO Trans 1988, 34, 54.
16. Overberger P, Pesacreta M,
Palevsky PM, VA/NIH Acute Renal Failure Trial Network. Management of renal
replacement therapy in acute kidney injury: a survey of practitioner
prescribing practices. Clin J Am Soc Nephrol 2007; 2:623.
17. Palevsky PM, Baldwin I,
Davenport A, et al. Renal replacement therapy and the kidney: minimizing the
impact of renal replacement therapy on recovery of acute renal failure. Curr
Opin Crit Care 2005; 11:548.
18. Palevsky PM, Liu KD, Brophy
PD, et al. KDOQI US commentary on the 2012 KDIGO clinical practice guideline
for acute kidney injury. Am J Kidney Dis 2013; 61:649.
19. Palevsky PM. Dialysis
modality and dosing strategy in acute renal failure. Semin Dial 2006, 19(165).
20. Paul M Palevsky, MD, (2022)
"Kidney replacement therapy (dialysis) in acute kidney injury in adults:
Indications, timing, and dialysis dose".
21. Ronco C, Tetta C, Mariano F,
et al. Interpreting the mechanisms of continuous renal replacement therapy in
sepsis: the peak concentration hypothesis. Artif Organs 2003; 27:792.
22. Salani M, Golper T. When
ESKD complicates disease management: GI bleeding and other GI illnesses. Semin
Dial 2020; 33:263.
23. Sanchez-Izquierdo JA, Perez
Vela JL, Lozano Quintana MJ, et al. Cytokines clearance during venovenous
hemofiltration in the trauma patient. Am J Kidney Dis 1997; 30:483.
24. Schiffl H, Lang SM, Fischer
R. Daily hemodialysis and the outcome of acute renal failure. N Engl J Med
2002; 346:305.
25. Schneider AG, Bellomo R,
Bagshaw SM, et al. Choice of renal replacement therapy modality and dialysis
dependence after acute kidney injury: a systematic review and meta-analysis.
Intensive Care Med 2013; 39:987.
26. Uehlinger DE, Jakob SM,
Ferrari P, et al. Comparison of continuous and intermittent renal replacement
therapy for acute renal failure. Nephrol Dial Transplant 2005; 20:1630.
27. VA/NIH Acute Renal Failure
Trial Network, Palevsky PM, Zhang JH, et al. Intensity of renal support in
critically ill patients with acute kidney injury. N Engl J Med 2008; 359:7.
28. Vinsonneau C, Camus C,
Combes A, et al. Continuous venovenous haemodiafiltration versus intermittent
haemodialysis for acute renal failure in patients with multiple-organ
dysfunction syndrome: a multicentre randomised trial. Lancet 2006; 368:379.
















